Biomarcadores plasmáticos para el Alzheimer y demencias relacionadas: una revisión y perspectivas para la neuropsicología clínica
La mayor precisión, confiabilidad y escalabilidad de las mediciones moleculares gracias a los recientes avances tecnológicos ha llevado a los biomarcadores sanguíneos a la vanguardia de la investigación sobre la enfermedad de Alzheimer (EA) y la demencia. Los procesos neurobiológicos centrales que subyacen a la demencia por EA, incluida la formación de placa de amiloide-ß (Aβ), la hiperfosforilación de tau y la propagación de ovillos neurofibrilares (NFT) de tau, se miden tradicionalmente mediante tomografía por emisión de positrones (PET) o líquido cefalorraquídeo (LCR) mediante vía de punción lumbar. Hasta hace poco, el poder discriminatorio de la abundancia de ß-amiloide y tau fosforilada (pTau) en sangre era limitado debido a la baja sensibilidad de la medición. Sin embargo, los avances en técnicas, como la matriz molecular única (Simoa) y la espectrometría de masas, han permitido la cuantificación ultrasensible de múltiples variaciones del péptido ß-amiloide, incluidos Aß 42 y Aß 40 , y múltiples isoformas de pTau, incluida la tau fosforilada. en treonina-181 (pTau181), treonina-217 (pTau217) y treonina-231 (pTau231). Paralelamente, se han desarrollado y validado medidas no específicas de neurodegeneración, lesión neuronal y función neuroinmune (inicialmente identificadas en el LCR) para su uso en sangre. Los biomarcadores sanguíneos son menos invasivos en comparación con las medidas tradicionales de LCR y PET de ß-amiloide y tau, ya que no requieren una punción lumbar ni la inyección de un radiotrazador, lo que los hace más factibles para ciertas poblaciones de pacientes y entornos clínicos con recursos limitados. .
Si bien existe un debate en curso sobre si la EA debe definirse exclusivamente en función de la biología (ß-amiloide y tau fosforilada) ( Høilund-Carlsen et al., 2023 ; Jack et al., 2018 ), sigue existiendo consenso en que la aplicación de Los biomarcadores basados en la caracterización in vivo de patologías específicas de la enfermedad deben usarse en combinación con un examen clínico y mediciones cognitivas (neuropsicológicas) y funcionales para proporcionar una imagen completa del estado neurocognitivo actual de un paciente. Hacerlo permitirá a los proveedores caracterizar y rastrear el alcance de la enfermedad neurodegenerativa actual. Debido a que el rendimiento y, por tanto, el interés en los biomarcadores sanguíneos para la EA y las demencias relacionadas (ADRD) aparentemente ha aumentado exponencialmente en los últimos años, anticipamos que estas medidas pronto serán tan omnipresentes en la práctica clínica como lo son actualmente. investigación. Los neuropsicólogos están en una posición única para utilizar los biomarcadores sanguíneos disponibles para mejorar la precisión del diagnóstico y el pronóstico y ayudar a guiar la toma de decisiones clínicas.
Un biomarcador puede definirse como una característica medida que actúa como indicador de un proceso biológico normal, un proceso patógeno o una respuesta a una exposición o intervención terapéutica ( FDA, 2016 ). Dada la utilidad clínica prevista de los biomarcadores sanguíneos para la identificación, el manejo y el tratamiento de enfermedades neurológicas relacionadas con la edad, es esencial que los neuropsicólogos que trabajan con adultos mayores comprendan cómo se pueden integrar los biomarcadores sanguíneos para mejorar el diagnóstico diferencial y personalizar planificación del tratamiento, recomendaciones y comentarios de los pacientes. Anticipamos que los biomarcadores sanguíneos se emplearán clínicamente para uno de cinco usos. En primer lugar, se utilizarán biomarcadores sanguíneos para ayudar con el diagnóstico etiológico, es decir, para confirmar o descartar la presencia de una enfermedad o subtipo de enfermedad específica. En segundo lugar, se aplicarán biomarcadores sanguíneos para cuantificar el potencial de un paciente de desarrollar una enfermedad o afección médica específica durante un tiempo determinado. En tercer lugar, se utilizarán biomarcadores sanguíneos para el pronóstico, lo que permitirá estimar la probabilidad de progresión de la enfermedad, recurrencia o aparición de un síntoma o evento clínico específico. En cuarto lugar, se emplearán biomarcadores sanguíneos longitudinalmente para evaluar continuamente el estado y la evolución de un proceso patológico específico. Por último, es probable que se utilicen biomarcadores sanguíneos para predecir la capacidad de respuesta al tratamiento de cada persona y para monitorear la participación del objetivo después de que se hayan iniciado intervenciones específicas.
En las secciones siguientes, brindaremos una descripción general de los biomarcadores sanguíneos comúnmente utilizados en el contexto de ADRD, revisaremos cómo las condiciones médicas comórbidas y los factores demográficos y genéticos pueden informar la interpretación de estos biomarcadores, describiremos los esfuerzos en curso para mover los biomarcadores sanguíneos. en la clínica y resaltar el papel central que probablemente desempeñarán los neuropsicólogos clínicos en la contextualización de los resultados de los biomarcadores sanguíneos para los pacientes.
BIOMARCADORES SANGUÍNEOS PARA LA ENFERMEDAD DE ALZHEIMER Y DEMENCIAS RELACIONADAS
En los últimos años, los biomarcadores sanguíneos para la ADRD se han explorado ampliamente como posibles alternativas a las opciones tradicionales, más invasivas y costosas. Los biomarcadores de la patología de la EA incluyen dos medidas de la carga de amiloide cerebral: el péptido Aβ de 42 aminoácidos (Aβ 42 ) y un péptido Aβ más corto de 40 aminoácidos (Aβ 40 ). La otra clase de biomarcadores sanguíneos utilizados para cuantificar la patología de la EA incluye medidas de pTau, incluidos pTau181, pTau217 y pTau231. Los biomarcadores sanguíneos de procesos biológicos que no son específicos de ninguna enfermedad incluyen la cadena ligera de neurofilamentos (NfL), un marcador no específico de lesión neuronal que se ha aplicado ampliamente en el ámbito de la investigación, la proteína ácida fibrilar glial (GFAP), un marcador de lesión de astrocitos o astrogliosis reactiva, y supuestas medidas de neuroinflamación, como la proteína 1 similar a quitinasa-3 (YKL40) y el receptor desencadenante expresado en células mieloides 2 (sTREM2).
Amiloide-β plasmático (Aβ)
Aβ es un producto de la proteína precursora de amiloide (APP) que se escinde para producir péptidos de longitudes variables, normalmente de 37 a 43 aminoácidos. Aβ 40 es la isoforma más abundante y la expresan neuronas sanas fuera del contexto de la EA. Las isoformas más largas de Aβ, concretamente Aβ 42, se expresan en niveles más altos en el contexto de la EA y son más propensas a autoagregarse. El Aβ 42 se encuentra en niveles elevados en las placas de Aβ del cerebro y, por lo tanto, se considera un marcador de amiloidosis cerebral ( Gu y Guo, 2013 ). La abundancia de Aβ 40 generalmente no cambia en la EA, mientras que la abundancia de Aβ 42 disminuye en el LCR y el plasma de personas con EA debido al mayor secuestro de Aβ 42 cerebral mediante la formación de placas amiloides, alteración del aclaramiento de Aβ 42 en el SNC y aumento de la oligomerización y agregación en formas menos detectables ( Hansson, 2021 ). Debido a que los niveles individuales de producción de Aβ pueden variar considerablemente, Aβ 40 se utiliza a menudo como factor de normalización de Aβ 42 para tener en cuenta la producción de Aβ específica de cada persona (es decir, la proporción de Aβ 42 a Aβ 40 ), mejorando la precisión predictiva de la positividad de Aβ cortical. Hansson, Lehmann, Otto, Zetterberg y Lewczuk, 2019 ; Janelidze et al., 2021 ).
Se ha demostrado que el Aβ 42/40 en plasma predice un Aβ 42/40 anormal en el LCR con un nivel de precisión que varía desde debajo de lo aceptable (AUC=0,64) hasta excelente (AUC=0,87), dependiendo en gran medida de la composición diagnóstica de la muestra y de la ensayo utilizado. En términos generales, los enfoques basados en espectrometría de masas para la medición de Aβ42/40/ en plasma han demostrado estimaciones superiores de β-amiloide en LCR y PET en comparación con los inmunoensayos ( Janelidze et al., 2021 ; Wojdała et al., 2023 ). Si bien el Aβ 42/40 en plasma demuestra una predicción de buena a excelente del estado positivo del Aβ en el cerebro, medido mediante imágenes PET (p. ej., AUC que oscilan entre 0,72 y 0,88) ( Bilgel et al., 2023 ; Schindler et al., 2019 ), otros Los estudios han encontrado que el Aβ 42/40 en plasma solo se correlaciona modestamente con el Aβ 42/40 en el LCR (p. ej., ρ de Spearman = 0,32-0,42) ( Wojdała et al., 2023 ). Ahora está bien establecido que las mediciones de Aβ en LCR y PET se vuelven anormales aproximadamente dos décadas antes de la aparición de los síntomas en el contexto de la EA. Dos estudios que compararon la dinámica temporal del Aβ 42/40 plasmático con las medidas del LCR y la PET encontraron que el Aβ 42/40 plasmático comienza a mostrar cambios significativos en el mismo punto del curso de la enfermedad (en comparación con el LCR) o antes (con respecto a la PET). ), lo que sugiere que el Aβ 42/40 en plasma puede ser útil como biomarcador temprano de la EA ( Bilgel et al., 2023 ; Palmqvist et al., 2019 ). En comparación con las medidas de Aβ en el LCR , las mediciones de Aβ en plasma tienden a tener un rango dinámico más limitado y muestran comparativamente más superposición entre individuos Aβ positivos y Aβ negativos ( Guo et al., 2023 ).
Tau fosforilada en plasma (pTau)
Las medidas plasmáticas de múltiples isoformas de pTau ahora están disponibles para uso en investigación. Estas medidas, que se cree que capturan la abundancia de la proteína tau soluble fosforilada en aminoácidos específicos (p. ej., treonina-181, treonina-217 y treonina-231), han demostrado ser fuertes predictores del amiloide cortical. Aunque la pTau en plasma solo ha mostrado correlaciones modestas con las medidas de NFT de tau definidas por PET ( Coomans et al., 2023 ), la abundancia en plasma de las proteínas pTau181, pTau217 y pTau231 se ha asociado con la EA confirmada por autopsia ( Brickman et al., 2021 ; Smirnov et al., 2022 ), y el pTau181 plasmático muestra un rendimiento comparable con la PET con tau para la identificación de individuos con Aβ elevado en LCR (AUC=0,83 para plasma, AUC=0,87 para PET con tau entorrinal) ( Coomans et al., 2023 ) . La modesta correlación de pTau en plasma con la PET con tau, su capacidad para discriminar entre individuos Aβ positivos y Aβ negativos con mayor precisión predictiva que las medidas plasmáticas de Aβ42, Aβ40 y Aβ 42/40 ( Smirnov et al., 2022 ), y la significativa El aumento de pTau181, pTau217 y pTau231 en plasma poco después de que un individuo se vuelve positivo para PET con amiloide (aproximadamente 15 a 20 años antes de la aparición de los síntomas) ( Barthélemy et al., 2020 ) sugiere que al menos un subconjunto de isoformas de pTau pueden servir como indicadores. de amiloidosis cerebral, incluso más que como indicadores de depósito de tau NFT definido por PET. Una comparación directa de las isoformas de tau encontró que el pTau217 en plasma supera a pTau181 y pTau231, y tiene un rendimiento similar al pTau217 en LCR para la predicción de la positividad para PET amiloide y la positividad para PET para tau (AUC>0,90) ( Palmqvist et al., 2020 ; Therriault et al., 2023 ). Las medidas de pTau181, pTau217 y pTau231 no tienden a mostrar elevaciones (en comparación con las de adultos mayores sanos) en trastornos neurodegenerativos no relacionados con la EA o en individuos con amiloide negativo con deterioro cognitivo leve, lo que indica la especificidad de estos biomarcadores sanguíneos. para EA ( Ashton et al., 2021 ; Thijssen, La Joie, et al., 2021a ).
Cadena ligera de neurofilamentos plasmáticos (NfL)
A diferencia de Aβ y pTau, que reflejan más específicamente cambios neuropatológicos de la EA, NfL es un marcador no específico de lesión neuronal. NfL es una proteína axónica de fibra de gran calibre que se libera de las neuronas con la degeneración de los axones mielinizados ( Gafson et al., 2020 ). Las elevaciones en NfL pueden ocurrir en una amplia gama de afecciones neurológicas en las que se produce daño neuronal, incluida la esclerosis múltiple, la lesión cerebral traumática, la demencia asociada al VIH y casi todos los trastornos neurodegenerativos más comunes ( Sjögren et al., 2000 ). Las mayores elevaciones en el NfL del LCR se observan en trastornos neurológicos agudos o de rápida progresión, como la esclerosis lateral amiotrófica y la enfermedad de Creutzfeldt-Jakob ( Gaetani et al., 2019 ). Las medidas recientemente desarrolladas de NfL en plasma muestran una correlación moderada con los niveles de NfL en LCR (ρ de Spearman = 0,59) ( Mattsson et al., 2017 ). Tanto el LCR como el NfL plasmático están elevados en el contexto del deterioro cognitivo leve y la EA, en comparación con los controles neurológicamente sanos, pero parecen producirse elevaciones significativas del NfL en etapas posteriores de la patogénesis de la EA, generalmente dentro de los 10 años posteriores al inicio de la demencia ( de Wolf et al., 2020 ; Mattsson et al., 2017 ). Como marcador no específico de neurodegeneración, el NfL plasmático se puede utilizar para controlar el estadio de la enfermedad, la progresión de la enfermedad y la respuesta al tratamiento. Sin embargo, este marcador es menos informativo con respecto al diagnóstico diferencial.
Marcadores plasmáticos de función neuroinmune.
La neuroinflamación, y más específicamente la respuesta inmune a la neuropatología mediada por microglía y astrocitos, se ha identificado como una característica central de múltiples enfermedades neurodegenerativas, incluidas la EA, la demencia vascular, la enfermedad de Parkinson y la esclerosis lateral amiotrófica ( Kwon y Koh, 2020 ). Si bien inicialmente solo se consideró una respuesta a la patología, una evidencia considerable sitúa la respuesta de la microglía y los astrocitos a la patología neurodegenerativa como un impulsor mecanicista del proceso de la enfermedad y un regulador de la progresión de la enfermedad ( Heneka et al., 2015 ). Por tanto, existe un interés creciente en la identificación y validación de biomarcadores de neuroinflamación y otras facetas de la activación neuroinmune. Un desafío para los esfuerzos dirigidos a la identificación de biomarcadores neuroinmunes en la sangre es que muchas de las proteínas inmunes candidatas también son altamente expresadas por células inmunes periféricas, particularmente en el contexto de agresiones inflamatorias como la infección ( Walker et al., 2023 ).
La GFAP plasmática, una proteína citoesquelética astrocítica intracelular que refleja la astrogliosis reactiva o la activación anormal de los astrocitos, actualmente se está utilizando ampliamente en la investigación de ADRD ( Chatterjee et al., 2021 ). Tanto la GFAP en LCR como la GFAP en plasma están elevadas en los participantes en el continuo de EA. Sin embargo, la GFAP en plasma y LCR muestra correlaciones positivas de bajas a moderadas (ρ de Spearman = 0,37-0,62) ( Benedet et al., 2021 ), y la GFAP en plasma discrimina con mayor precisión a los individuos Aβ positivos de los Aβ negativos ( Pereira et al., 2021 ). Específicamente, se ha demostrado que la GFAP en plasma discrimina entre individuos Aβ positivos con demencia por EA de individuos Aβ negativos sin deterioro cognitivo con excelente precisión (AUC de 0,90) ( Chatterjee, Pedrini, et al., 2023a ). Además, la GFAP plasmática se ha asociado con la abundancia de Aβ cerebral postmortem ( Cousins et al., 2023 ) y medidas de astrocitosis reactiva definidas por PET ( Chatterjee, Doré, et al., 2023b ). Un segundo biomarcador astrocítico, YKL-40, participa en la remodelación de tejidos y se expresa durante las respuestas inflamatorias. El LCR YKL-40 se considera un marcador de neuroinflamación y se ha descubierto que aumenta con la acumulación de placa Aβ ( Craig-Schapiro et al., 2010 ) y diferencia la EA de los controles sanos ( Wennström et al., 2015 ). YKL40 en plasma muestra asociaciones bajas (r = 0,24) a moderadas (ρ = 0,40) con YKL-40 en LCR y no está relacionado con Aβ cortical ( Craig-Schapiro et al., 2010 ; Giannisis et al., 2022 ). El YKL-40 plasmático se ha asociado más fuertemente con enfermedades neurodegenerativas distintas de la EA que con la demencia por EA ( Villar-Piqué et al., 2019 ).
Otro marcador cada vez más popular de la función neuroinmune, la forma soluble del receptor desencadenante expresado en las células mieloides 2 (sTREM2), se expresa principalmente en la microglía y regula la eliminación microglial del Aβ cerebral, la señalización inflamatoria microglial y la supervivencia celular ( Xue & Du, 2021 ). Aunque la abundancia de sTREM2 en el LCR se ha asociado con la microgliosis definida por PET, así como con los síntomas clínicos, aún no se ha establecido el papel potencial del sTREM2 plasmático como biomarcador para uso clínico ( Xue y Du, 2021 ). Se ha descubierto que sTREM2 en LCR tiene una correlación positiva modesta (r ~ 0,20) con sTREM2 en plasma, y la magnitud de esta asociación parece depender de la presencia de enfermedad del SNC y del ensayo de sTREM2 específico utilizado ( Bekris et al., 2018 ; Španić Popovački et al., 2023 ). Al menos un estudio ha encontrado una correlación inversa entre el LCR y el sTREM2 plasmático ( Park et al., 2021 ). Si bien en un estudio se encontró que el sTREM2 en el LCR aumenta en personas con deterioro cognitivo leve y EA, en comparación con los controles sanos, estas diferencias grupales no se extendieron al sTREM2 en plasma ( Bekris et al., 2018 ). A pesar de estos hallazgos, otros han encontrado que el sTREM2 en plasma se asocia positivamente con el volumen de hiperintensidad de la sustancia blanca, las medidas de patología tau cortical definidas por PET y las medidas de NfL en el LCR ( Park et al., 2021 ; Tsai et al., 2021 ). Las asociaciones deficientes e inconsistentes entre sTREM2 en LCR y las medidas sanguíneas de la misma proteína sugieren que las mediciones de sTREM2 en sangre pueden ser un indicador de la activación inmune periférica, en lugar de central.
BIOMARCADORES SANGUÍNEOS, COGNICIÓN Y PREDICCIÓN DE LA DEMENCIA
De acuerdo con la de sus análogos en el LCR, una mayor abundancia de pTau181, pTau217, pTau231, NfL y GFAP, y una menor abundancia de Aβ 42/40 en sangre se han asociado con un deterioro cognitivo subjetivo y sutil ( Baldacci et al., 2020 ; Bangen et al., 2021 ; Cullen et al., 2021 ; Thomas et al., 2021 ), peor rendimiento cognitivo y mayores tasas de deterioro cognitivo en algunos, pero no en todos, estudios de individuos cognitivamente normales y con deterioro cognitivo ( Frank et al. , 2022 ; Hansson, 2021 ; Milà-Alomà et al. , 2022 ; Respaldando la idea de que estos biomarcadores sanguíneos pueden usarse para el seguimiento de enfermedades, los aumentos longitudinales en pTau217 y NfL se han relacionado con mayores tasas de deterioro cognitivo independientemente de los niveles iniciales de biomarcadores ( Matsson-Carlgren et al., 2021 ; Mielke et al. , 2019 ). Si bien el GFAP en plasma demuestra una asociación constante con la cognición ( Gonzales et al., 2022 ), el YKL-40 en plasma ha mostrado resultados mixtos. Específicamente, algunos estudios han relacionado el YKL-40 en plasma con una función cognitiva más deficiente ( Pase et al., 2020 ), mientras que otros han encontrado que el YKL-40 en plasma no predice la cognición o el deterioro cognitivo ( Brosseron et al., 2023 ; Craig-Schapiro et al., 2010 ). Inesperadamente, un estudio encontró que un mayor YKL-40 se asociaba con un mejor rendimiento de la memoria ( Vergallo et al., 2020 ). Se sabe menos sobre la asociación de la abundancia de sTREM2 en sangre con la cognición, aunque esta proteína se ha asociado con el deterioro cognitivo en individuos tau positivos, pero no tau negativos ( Tsai et al., 2021 ).
Como se esperaba, dadas sus asociaciones con la cognición, las medidas sanguíneas de la patología de la EA, la lesión neuronal y la activación neuroinmune predicen la aparición futura de demencia ( Silva-Spínola et al., 2023 ; Simrén et al., 2021 ). Si bien pTau181, NfL y GFAP en plasma pueden predecir con precisión el riesgo de demencia y tienden a aumentar su concentración a medida que avanza la etapa de la enfermedad, las asociaciones del Aβ 42/40 en plasma con resultados clínicamente definidos han sido menos consistentes ( Janelidze et al., 2016 ; Simrén et al., 2021 ; Wojdała et al., 2023 ). Se ha descubierto que pTau181 y GFAP en plasma discriminan a personas con demencia de personas sin deterioro cognitivo con una precisión excelente (AUC = 0,8-0,9), mientras que Aβ 42/40 y NfL en plasma han tendido, con algunas excepciones, a demostrar una precisión predictiva más baja en este contexto. (El AUC suele ser de alrededor de 0,70) ( Baiardi et al., 2022 ; Benussi et al., 2022 ; Simrén et al., 2021 ).
Además de clasificar el riesgo de demencia, estos biomarcadores sanguíneos también han demostrado capacidad para discriminar entre etiologías de demencia. pTau181, pTau217 y pTau231 pueden diferenciar la demencia por EA de la demencia sin EA con una precisión excelente o sobresaliente (AUC = 0,84-0,96) ( Ashton et al., 2021 ; Kivisäkk et al., 2023 ). Aunque no con tanta precisión como pTau, se ha demostrado que GFAP diferencia la demencia por EA de la demencia sin EA. Por ejemplo, Baiardi et al. (2022) encontraron que el GFAP en plasma tenía un AUC = 0,70 para discriminar la demencia por EA de la demencia sin EA. Aunque el Aβ 42/40 se considera un marcador de procesos patológicos específicos de la EA, al menos un estudio ha encontrado que el Aβ 42/40 discrimina mal la EA de la demencia frontotemporal o la demencia con cuerpos de Lewy ( Tijssen et al., 2022 ). Se ha descubierto que la precisión predictiva del Aβ 42/40 en plasma varía en gran medida según el ensayo y las características del ensayo ( Tijssen, Verberk, et al., 2021b ). Los marcadores sanguíneos de YKL-40 y sTREM2 han mostrado resultados mixtos para la clasificación del estado clínico, y se ha descubierto que YKL-40 no es específico con respecto a las etiologías de la demencia ( Španić Popovački et al., 2023 ) ( Ashton et al., 2019 ; Wilczyńska, Maciejczyk, Zalewska y Waszkiewicz, 2021 ).
También se ha demostrado que varios biomarcadores sanguíneos predicen el riesgo futuro de demencia y la probabilidad de progresión de deterioro cognitivo leve a demencia dentro de un período de seguimiento específico. pTau181 y GFAP han demostrado una precisión excelente para discriminar personas con deterioro cognitivo leve que progresan a demencia por EA de personas con deterioro cognitivo leve estable (AUC = 0,83) ( Kivisäkk et al., 2023 ). En comparación, la NfL plasmática ha mostrado un poder predictivo comparativamente más débil en este contexto (AUC=0,73) ( Kivisäkk et al., 2023 ). Estos biomarcadores pueden mostrar una precisión predictiva aún mejor para la progresión del deterioro cognitivo leve cuando se combinan, en comparación con su precisión como predictores individuales. Por ejemplo, cuando se combinan GFAP y pTau181, la capacidad de predecir la progresión de DCL a demencia por EA mejora a un AUC de 0,89 ( Kivisäkk et al., 2023 ).
Aunque los biomarcadores sanguíneos han demostrado una clara utilidad para discriminar la etiología de la demencia y predecir el riesgo de demencia, se necesita investigación adicional para establecer puntos de corte de biomarcadores clínica y patológicamente relevantes que puedan usarse para agrupar a los participantes en grupos de riesgo para un resultado neurocognitivo particular. Los estudios que han informado puntos de corte óptimos para discriminar la positividad de β-amiloide cortical utilizando Aβ 42/40 en plasma han arrojado resultados variados. Por ejemplo, se han recomendado puntos de corte de Aβ 42/40 en plasma que oscilan entre 0,076 y 0,1218 ( Feinkohl et al., 2020 ; Pais, Forlenza y Diniz, 2023 ; Schindler et al., 2019 ; West et al., 2021 ). . Dada la variabilidad entre estudios en los puntos de corte entre los biomarcadores sanguíneos, se recomienda el uso de puntos de corte específicos del estudio en el contexto de la investigación ( Pais et al., 2023 ). Sin embargo, en última instancia, el objetivo es establecer puntos de corte que sean lo suficientemente confiables en todas las muestras para ofrecer una predicción precisa en el entorno clínico. Las pautas de la Asociación de Alzheimer para el uso de biomarcadores de EA en sangre recomiendan que se establezcan puntos de corte antes del uso clínico generalizado de biomarcadores de ADRD en sangre ( Hansson et al., 2022 ). Uno de los muchos desafíos de este enfoque es que la salud, el estilo de vida y los factores ambientales específicos de cada persona pueden influir en el punto de corte óptimo ( Dark et al., 2023 ). Como se analiza en las siguientes secciones, se necesita trabajo adicional para comenzar a abordar esta importante cuestión.
EL EFECTO DE LAS CONDICIONES MÉDICAS COMÓRBIDAS
Varios estudios han demostrado que las condiciones médicas comórbidas pueden afectar los niveles de biomarcadores de ADRD en sangre. Por ejemplo, la hiperlipidemia, la hipertensión, la cardiopatía isquémica, la diabetes y la enfermedad renal crónica se han asociado con una abundancia plasmática alterada de Aβ 40 y Aβ 42 ( Dark et al., 2023 ; Janelidze et al., 2016 ; O’Bryant, Petersen , Hall y Johnson, 2023 ). La diabetes y la enfermedad renal crónica también se han asociado con un NfL plasmático más alto, mientras que un índice de masa corporal (IMC) más alto se ha relacionado con diferencias en los niveles de pTau181, pTau217 y NfL ( Brickman et al., 2021 ; Dark et al., 2023). ; Mielke et al., 2022 ; O’Bryant et al., 2023 ). Sin embargo, algunas de estas asociaciones se atenúan –o incluso se eliminan– después de tener en cuenta la edad y el sexo ( Mielke et al., 2022 ). Como regulador fisiológico de la excreción de proteínas, se sabe que la función renal (normalmente definida por la tasa de filtración glomerular estimada [eGFR] y los niveles de creatina) influye en un gran segmento del proteoma ( Tin et al., 2023 ). En consecuencia, una función renal deficiente se ha asociado con niveles plasmáticos más altos de NfL, pTau181 y pTau217 ( Janelidze, Barthélemy, He, Bateman y Hansson, 2023 ; Lehmann et al., 2023 ; Zhang et al., 2023 ). Además, se ha demostrado que la función renal modifica la capacidad de pTau181 para predecir la positividad de Aβ en el LCR; sin embargo, no todos los estudios muestran que la precisión diagnóstica se vea afectada ( Lehmann et al., 2023 ; Zhang et al., 2023 ). Además, la función renal no muestra una fuerte asociación con el Aβ 42/40 en plasma , ni parece afectar la precisión del diagnóstico o el punto de corte óptimo para este biomarcador ( Zhang et al., 2023 ). Se ha demostrado que múltiples afecciones, incluidas la enfermedad renal crónica, el infarto de miocardio y el accidente cerebrovascular, modifican los puntos de corte óptimos utilizados para pTau181 y pTau217 ( Mielke et al., 2022 ). Sin embargo, existe cierta evidencia de que el uso de una proporción de pTau a tau total puede reducir el efecto de las comorbilidades en la medición de pTau ( Janelidze et al., 2023 ).
EL EFECTO DEL GENOTIPO
Además de los factores de salud y las condiciones médicas comórbidas, el genotipo parece influir en la abundancia de biomarcadores sanguíneos. Si bien no siempre es así ( Feinkohl et al., 2020 ), se ha encontrado una menor abundancia de Aβ 42/40 ( Schindler et al., 2019 ) y una mayor abundancia de pTau181 y pTau231 en personas con y sin deterioro cognitivo con al menos una copia del Alelo APOE ε4 ( Brickman et al., 2022 ; Salami et al., 2022 ; Snellman et al., 2023 ). Dado que el Aβ 42/40 y el pTau en plasma son indicadores de patología de la EA, se deduce que las principales variantes de riesgo de la EA que influyen en la patología de la EA también influyen en el nivel de biomarcadores de la EA, incluso antes de que los individuos se vuelvan sintomáticos. Por el contrario, los biomarcadores que no son específicos de la patología de la EA, incluidos NfL y GFAP, son menos sensibles a la posesión de genes de riesgo de EA ( Asken et al., 2020 ; Baldacci et al., 2020 ; Malek-Ahmadi et al., 2023 ; Snellman et al., 2023 ). Aún se desconoce si otras variantes de riesgo de ADRD influyen en la abundancia de estos biomarcadores en la sangre.
EL EFECTO DE LOS FACTORES RAZA/ÉTNICOS Y EL SEXO
La prevalencia de la EA y la demencia por todas las causas difiere según la raza y el origen étnico autoinformados, y la mayoría de los estudios encuentran que las personas negras e hispanas tienen tasas elevadas de demencia en comparación con los blancos no hispanos ( Mehta y Yeo, 2017 ; Moon, Badana, Hwang , Sears y Haley, 2019 ). A pesar de estas elevadas tasas de prevalencia, los adultos negros, hispanos y otros no blancos han estado históricamente subrepresentados en la investigación sobre la demencia, incluidos los estudios de biomarcadores antes mencionados, debido a la dependencia de poblaciones clínicas (p. ej., centros de memoria) en lugar del reclutamiento basado en la población, y la implementación de criterios de inclusión/exclusión que seleccionan desproporcionadamente a participantes no blancos fuera del estudio ( Gleason et al., 2019 ; Raman et al., 2021 ). La subrepresentación global de adultos no blancos en la investigación sobre la demencia, particularmente en estudios más invasivos que requieren la recolección de LCR y neuroimagen PET, puede tener múltiples consecuencias negativas en el desarrollo de biomarcadores, entre las que se incluye la limitada generalización de los puntos de corte o los basados en biomarcadores. puntuaciones de predicción ( Barnes & Bennett, 2014 ; Lim et al., 2023 ; Weiner et al., 2023 ).
En comparación con las personas blancas con demencia por EA clínicamente definida, los estudios de neuroimagen por PET y autopsias han demostrado que las personas no blancas con demencia por EA clínicamente definida tienen más probabilidades de tener patología mixta y menos probabilidades de tener amiloidosis cerebral ( Barnes et al., 2015 ; Dark y Walker, 2023 ; Wilkins et al., 2022 ). Con base en estos hallazgos, múltiples estudios han tratado de determinar si los niveles de biomarcadores sanguíneos difieren según la raza o el origen étnico entre los estratos de diagnóstico. Si bien varios estudios no han encontrado diferencias significativas en la abundancia de biomarcadores de ADRD en plasma en función de la raza ( Brickman et al., 2021 ; Hall, Petersen, Johnson y O’Bryant, 2022 ; Ramanan et al., 2023 ; Windon et al. , 2022 ), otros han encontrado evidencia de diferencias raciales ( O’Bryant et al., 2022 ; Schindler et al., 2022 ). Por ejemplo, se ha descubierto que los participantes blancos tienen un Aβ 42/40 más bajo en comparación con los participantes negros y un NfL más alto en comparación con los mexicoamericanos ( O’Bryant et al., 2023 ; Schindler et al., 2022 ). Otro estudio encontró que la abundancia plasmática de Aβ 40 , Aβ 42 , Aβ 42/40 y NfL difería según la raza de una manera que dependía parcialmente del estadio de la enfermedad clínicamente definido, y los participantes negros mostraban una menor abundancia plasmática de cada biomarcador en comparación con los no. -Hispanos blancos y mexicoamericanos ( Hall et al., 2022 ). Un estudio que encontró que las asociaciones entre los biomarcadores plasmáticos y los resultados clínicos son más fuertes para los participantes blancos, en comparación con los participantes negros. También encontraron que los resultados no se mantuvieron después de excluir a los participantes con enfermedad renal crónica, lo que sugiere que las diferencias basadas en la raza en los biomarcadores de ADRD pueden explicarse por la prevalencia diferencial de enfermedades comórbidas entre los grupos raciales ( Ramanan et al., 2023 ). Otro estudio que encontró diferencias significativas en los niveles de biomarcadores cuando los análisis se estratificaron por raza autoinformada vio que estas diferencias grupales disminuyeron cuando los análisis se estratificaron por ascendencia genética ( Hajjar et al., 2022 ). Estos resultados sugieren que las construcciones sociales pueden impulsar diferencias relacionadas con la raza en los biomarcadores plasmáticos, en lugar de diferencias biológicas inherentes.
Aún no está claro si las concentraciones de biomarcadores en sangre difieren según el sexo. Si bien algunos estudios no muestran diferencias en la abundancia de biomarcadores entre hombres y mujeres ( Baldacci et al., 2020 ; Mattsson et al., 2017 ; Triant, Lee, Hadigan y Grinspoon, 2007 ), otros sugieren que los hombres tienden a tener una mayor patogenicidad. patrón caracterizado por niveles más bajos de Aβ 42/40 ( Schindler et al., 2019 ; Snellman et al., 2023 ) y niveles más altos de NfL ( Lin, Lee, Wang y Fuh, 2018 ). Sin embargo, este patrón se invirtió para la GFAP en sangre, que tiende a mostrar una mayor abundancia entre las mujeres ( Benedet et al., 2021 ; Saloner et al., 2023 ). También existe evidencia de diferencias de sexo en la asociación de estos biomarcadores con resultados neurocognitivos. Por ejemplo, en las mujeres, una mayor abundancia de pTau se asocia más fuertemente con una elevación de la β-amiloide cortical y de la tau, y una mayor atrofia del lóbulo temporal medial y una disminución de la memoria verbal en comparación con los hombres ( Saloner et al., 2023 ; Tsiknia et al., 2022 ).
PLATAFORMAS DE BIOMARCADORES EN SANGRE PARA USO CLÍNICO
La aplicación clínica de los biomarcadores sanguíneos sigue siendo debatida activamente entre los principales investigadores, sin un consenso claro entre los proveedores de atención primaria, los especialistas en el cuidado de la memoria o los organismos reguladores. Se estima que hay una docena o más de análisis de sangre en diversas etapas de desarrollo en el sector privado, aunque puede ser difícil evaluar el número exacto debido a los derechos de propiedad intelectual, los retrasos en la difusión de los resultados de las investigaciones internas, etc. para obtener una lista más completa de biomarcadores en desarrollo, consulte Hampel et al., 2023 ). En los Estados Unidos, la FDA no ha aprobado ningún ensayo basado en sangre para el diagnóstico de EA, pero no es necesaria la aprobación para que dichas pruebas se comercialicen al público, se apliquen clínicamente junto con otra información de diagnóstico o se utilicen en entornos de investigación (por ejemplo). Para obtener una descripción más completa de los tipos de biomarcadores y los pasos de aprobación regulatoria, consulte Cummings & Kinney, 2022 ). Varias pruebas desarrolladas en laboratorio (LDT) basadas en sangre para la cuantificación de biomarcadores de ADRD han recibido la designación de dispositivo innovador de la FDA para su medición. La FDA otorga la designación de dispositivo innovador a medidas que evalúan una afección grave con el potencial de ofrecer una mejora sustancial con respecto a los diagnósticos existentes. A continuación, describimos los biomarcadores sanguíneos que están actualmente disponibles para uso clínico o que están en camino a la clínica (consulte también la Tabla 1 ).
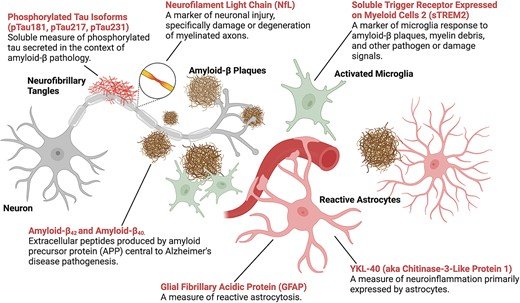
Biomarcadores sanguíneos para la enfermedad de Alzheimer y demencias relacionadas. Los biomarcadores para la patología, la neurodegeneración y la activación neuroinmunitaria de la enfermedad de Alzheimer (texto rojo) se ilustran en el contexto de las neuronas, las células gliales y la patología de la enfermedad de Alzheimer (placas de β-amiloide y ovillos neurofibrilares de tau). Creado con BioRender.com .
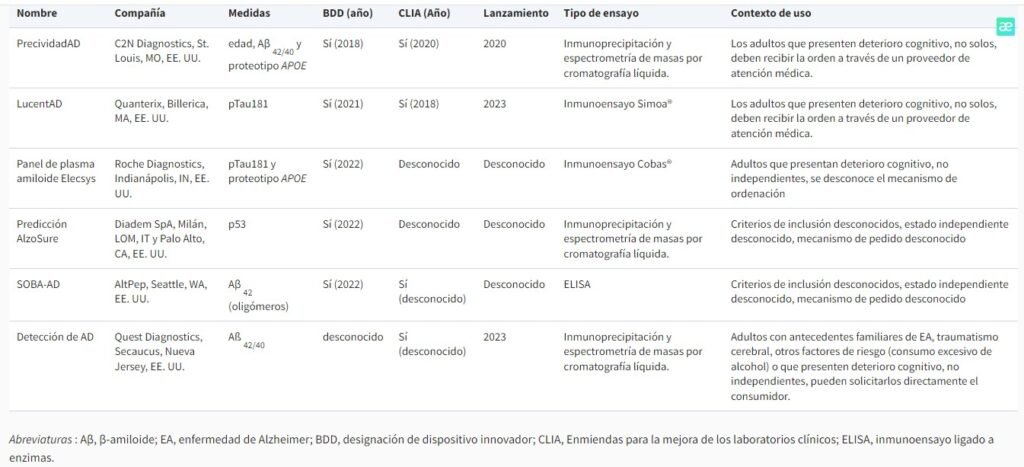
PrecividadAD
nunciado como una medida de detección basada en sangre para la patología cerebral de β-amiloide, Precivity utiliza la edad cronológica, Aβ 42/40 y el proteotipo APOE para determinar la probabilidad de positividad de β-amiloide en individuos evaluados para detectar EA. Aprovechando estas medidas para calcular una puntuación de probabilidad de amiloide (APS), la prueba Precivity ofrece AUC de 0,88-0,90 para predecir el estado de Aβ PET (+/-), y la medición de Aβ 42/40 representa la mayor parte de la variación (es decir, AUC de 0,81-0,84) ( Fogelman et al., 2023 ; Hu et al., 2022 ). Los resultados de PrecivityAD2 (que agregó pTau217 al modelo predictivo para mejorar la precisión) no han sido revisados por pares, pero una presentación de póster de 2023 sugirió que proporciona AUC de 0,95 a 0,97 (no publicado).
LucentAD
LucentAD utiliza pTau181 para ayudar en la evaluación diagnóstica de la EA. Aunque los resultados del ensayo no han sido revisados por pares, una presentación en póster de 2022 sugirió que muestra un AUC de 0,90 para discriminar diagnósticos de EA confirmados por LCR (n = 34) de controles cognitivamente normales emparejados por edad y sexo (n = 36). ( Malyavantham et al., 2022 ).
Panel de plasma amiloide Elecsys
Este panel utiliza el proteotipo pTau181 y APOE para identificar a las personas que justifican pruebas de AD confirmatorias adicionales con PET o LCR; Los resultados que examinaron su desempeño discriminativo para el estado de Aβ CSF (+/-) mostraron un AUC de 0,85 (n=693) ( Palmqvist et al., 2023 ).
Predicción AlzoSure
AlzoSure Predict mide una variante conformacional específica de la EA de la proteína p53, lo que da como resultado un AUC casi perfecto de 0,99 para discriminar la EA definida neuropsicológicamente de los individuos sin deterioro cognitivo, así como la conversión a la EA a los 36 y 72 meses de seguimiento. puntos de tiempo arriba (n=482) ( Piccirella et al., 2022 ). El uso previsto de AlzoSure Predict aún no se ha especificado.
SOBA-AD
El ensayo SOBA-AD, que captura una forma oligomérica única de Aβ 42 , ha informado un AUC casi perfecto de 0,99 para discriminar individuos cognitivamente normales de casos de DCL y EA diagnosticados clínicamente y por autopsia (n = 379) ( Shea et al. ., 2022 ). Aún no se ha informado sobre el uso previsto de SOBA-AD.
Detección de AD
Como primer producto directo al consumidor, AD-Detect utiliza Aβ 42/40 para evaluar el riesgo de tener patología de EA en adultos con deterioro cognitivo leve o demencia. En particular, la campaña de marketing de AD-Detect sugiere que también se puede aplicar entre personas que tienen antecedentes familiares de EA o que han estado expuestas a factores de riesgo, como una lesión cerebral traumática. Aunque los resultados del ensayo no han sido revisados por pares, una presentación en póster de 2022 informó un AUC de 0,86 para discriminar individuos con PET Aβ positivo de controles cognitivamente normales de la misma edad y sexo (n = 209) ( Weber, Kim, Goldman, Racke y Clarke, 2022 ). El enfoque directo al consumidor ha sido recibido con críticas ( Rogers, 2023 ).
CONSIDERACIONES PARA NEUROPSICOLOGÍA
Los biomarcadores predictivos y diagnósticos de la ADRD seguirán abriéndose paso en el ámbito clínico, probablemente con más fervor que las medidas en LCR y PET. Gastos reducidos, niveles deseables de precisión y mínima invasividad son características de la ola actual de biomarcadores sanguíneos que los han convertido en herramientas prácticas para médicos e investigadores. La utilidad potencial de los biomarcadores plasmáticos en el contexto de la ADRD se extiende a múltiples funciones, incluida la detección de pacientes, la información sobre diagnósticos etiológicos, la predicción o pronóstico y el seguimiento de la enfermedad. Al igual que los resultados de los estudios neurorradiológicos y la cuantificación de marcadores del LCR, la información de biomarcadores sanguíneos específicos del paciente se pondrá a disposición de los pacientes mediante proveedores remitentes y a través de plataformas directas al consumidor. Si bien anticipamos que los neuropsicólogos, neurólogos y otros proveedores podrán utilizar los resultados de estos biomarcadores sanguíneos para informar su evaluación clínica y planificación/monitoreo del tratamiento, los neuropsicólogos a menudo estarán en la mejor posición para integrar la información de los biomarcadores con un caracterización complementaria de las capacidades cognitivas y funcionales de una manera que determinará el diagnóstico sindrómico y brindará apoyo adicional para un diagnóstico y pronóstico etiológico. Aunque la expectativa es que los biomarcadores sanguíneos se interpreten en el contexto de un estudio clínico completo, algunos pacientes tendrán preguntas sobre cómo interpretar las lecturas cuantitativas y las descripciones cualitativas proporcionadas por las plataformas de biomarcadores sanguíneos. Estas preguntas inevitablemente llegarán a los neuropsicólogos que trabajan con adultos mayores. Si bien anticipamos que los biomarcadores sanguíneos serán valiosos, particularmente para la detección de ensayos clínicos o para estimar la probabilidad de patología cerebral de EA en personas con deterioro cognitivo leve o demencia, sin la orientación y el contexto adecuados estas pruebas tienen el potencial de ser mal utilizadas y malinterpretados, particularmente en el entorno directo al consumidor.
Una forma de limitar el daño potencial causado por los biomarcadores sanguíneos es establecer y cumplir con un conjunto de criterios de uso de elegibilidad. En 2022, la Asociación de Alzheimer publicó directrices para el uso de biomarcadores sanguíneos de la EA ( Hansson et al., 2022 ). Estas directrices recomiendan que las medidas de patología de la EA basadas en sangre disponibles comercialmente no se utilicen en personas asintomáticas o cognitivamente normales. También se ha desaconsejado el uso de estas pruebas como medidas de detección de la población general y como pruebas directas al consumidor ( Hansson et al., 2022 ). Sin la capacidad de tomar medidas viables para el tratamiento o la mitigación del riesgo (en el momento de escribir este artículo, los medicamentos modificadores de la enfermedad de EA están aprobados sólo para pacientes sintomáticos de EA) y la elevada probabilidad de falsos positivos en el contexto de una menor prevalencia de la enfermedad, el riesgo introducido por La evaluación de individuos cognitivamente normales puede superar el beneficio potencial. Las directrices alientan además a los proveedores a considerar las ramificaciones de revelar los resultados de los biomarcadores a personas asintomáticas ( Hansson et al., 2022 ). Estudios separados encontraron que los participantes que supieron que eran positivos para un biomarcador de EA (es decir, estado elevado de amiloide-β o APOE ε4 positivo) no mostraron niveles elevados de ansiedad, depresión o tendencias suicidas en comparación con los participantes que supieron que eran biomarcadores negativos. ( Green et al., 2009 ; Grill et al., 2020 ). Sin embargo, como era de esperar, los participantes a los que se les dijo que tenían niveles elevados de β-amiloide tenían una mayor preocupación por su riesgo de padecer EA ( Grill et al., 2020 ).
Una consecuencia prevista del lanzamiento de biomarcadores sanguíneos de diagnóstico es un fuerte aumento en las derivaciones de personas con y sin deterioro cognitivo objetivo que han sido identificados por biomarcadores sanguíneos con cambios patológicos de la enfermedad de Alzheimer. En consecuencia, los neuropsicólogos clínicos deben estar preparados para descartar el deterioro cognitivo cuando no lo hay y, en el caso de decrementos cognitivos significativos, hacer uso de las mediciones de biomarcadores sanguíneos disponibles para informar el diagnóstico diferencial, mejorar la precisión del pronóstico y personalizar las recomendaciones de tratamiento. .
CONCLUSIÓN
Los neuropsicólogos clínicos que trabajan con poblaciones de adultos mayores deben estar preparados para responder preguntas fundamentales sobre el valor potencial y la utilidad de los biomarcadores sanguíneos. Los neuropsicólogos clínicos también deberán estar equipados para ayudar a los pacientes y a los proveedores de atención médica a ubicar los hallazgos de los biomarcadores en el contexto apropiado, teniendo en cuenta las capacidades cognitivas y funcionales, así como los factores psicosociales relevantes. A medida que los biomarcadores sanguíneos para la ADRD se vuelven más comunes en el entorno clínico, anticipamos que se pedirá a los neuropsicólogos que desempeñen un papel central en la educación de los pacientes sobre el significado de los hallazgos de los biomarcadores y los límites y la incertidumbre que rodean estas medidas. En última instancia, el objetivo debe ser ofrecer expectativas realistas y reducir la ansiedad innecesaria del paciente y del cuidador.
Referencias
Archives of Clinical Neuropsychology , volumen 39, número 3, mayo de 2024, páginas 313–324, https://doi.org/10.1093/arclin/acae019




